Tổ Hóa học báo cáo chuyên đề: CHUYÊN ĐỀ 3: LIÊN KẾT HÓA HỌC
- Học sinh phát biểu được khái niệm về liên kết hóa học, hiểu được quy tắc octet, liên kết ion , liên kết cộng hóa trị, liên kết hydrogen và tương tác van der Waals, năng lượng liên kết hóa học.
- Vận dụng quy tắc octet để giải thích sự hình thành liên kết hóa học cho các nguyên tố nhóm A.
- Giải thích được sự hình thành liên kết ion , liên kết cộng hóa trị của một số chất cơ bản.
- Viết được công thức electron, công thức Lewis, công thức cấu tạo của một số chất cơ bản.
- Liên kết hydrogen là một loại liên kết hóa học, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn ít nhất một cặp electron hoá trị chưa tham gia liên kết. |
CHUYÊN ĐỀ 3: LIÊN KẾT HÓA HỌC
A. MỤC TIÊU CHUYÊN ĐỀ “LIÊN KẾT HÓA HỌC”
I. MỤC TIÊU
1. Kiến thức
- Học sinh phát biểu được khái niệm về liên kết hóa học, hiểu được quy tắc octet, liên kết ion , liên kết cộng hóa trị, liên kết hydrogen và tương tác van der Waals, năng lượng liên kết hóa học.
- Vận dụng quy tắc octet để giải thích sự hình thành liên kết hóa học cho các nguyên tố nhóm A.
- Giải thích được sự hình thành liên kết ion , liên kết cộng hóa trị của một số chất cơ bản.
- Viết được công thức electron, công thức Lewis, công thức cấu tạo của một số chất cơ bản.
2. Năng lực:
- Năng lực tự chủ tự học: HS nghiêm túc thực hiện nhiệm vụ, trả lời câu hỏi tìm hiểu về quy luật
- Năng lực giải quyết vấn đề và sáng tạo: Từ kiến thức đã học HS vận dụng giải quyết các hiện tượng trong tự nhiên và giải quyết các câu hỏi bài tập
- Năng lực giao tiếp và hợp tác: Biết chủ động giao tiếp khi có vấn đề thắc mắc. Thông qua làm việc nhóm
- Năng lực nhận thức kiến thức hóa học:
+ HS trình bày được quy tắc octet với các nguyên tố nhóm A, biết cách mô tả sự hình thành liên kết ion và liên kết cộng hóa trị..
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
+ Vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A.
3. Phẩm chất
- Trung thực: Thật thà, ngay thẳng trong kết quả làm việc nhóm.
- Trách nhiệm: Có tinh thần trách nhiệm cao để hoàn thành tốt nhiệm vụ được phân công.
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Có niềm say mê, hứng thú với việc khám phá và học tập môn hóa học.
B. NỘI DUNG CHUYÊN ĐỀ “LIÊN KẾT HÓA HỌC”
BÀI 10: QUY TẮC OCTET
I. KHÁI NIỆM VỀ LIÊN KẾT HÓA HỌC
- Phân tử được tạo nên từ các nguyên tử bằng các liên kết hoá học.
- Liên kết hóa học là sự kết hợp giữa các nguyên tử để tạo thành phân tử hoặc tinh thể bền vững hơn.
- Chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa mới tham gia vào quá trình tạo liên kết (electron hóa trị).
- Số electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
.jpg)
II. QUY TẮC OCTET
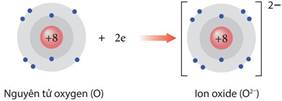
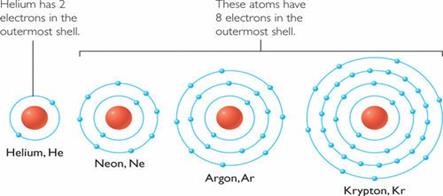
- Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình bền vững như của khí hiếm. Vì các khí hiếm đều có 8 electron ở lớp ngoài cùng (trừ He có 2 electron) nên quy tắc này được gọi là quy tắc octet.
BÀI 11: LIÊN KẾT ION
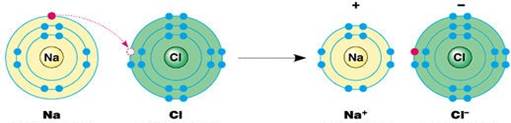
1. Ion và sự hình thành liên kết ion:
điện tích trái dấu. - Ngoài các ion được tạo thành từ một nguyên tử (ion đơn nguyên tử) như Na +, Mg2+, Cl-… còn có các ion tạo thành từ hai hay nhiều nguyên tử (ion đa nguyên tử) như NH 4+, NO3-, HCO3-… - Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
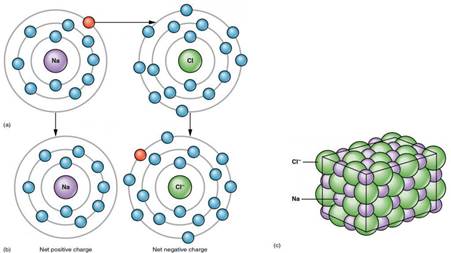
2. Tinh thể ion:
| ||
| Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện. |
|
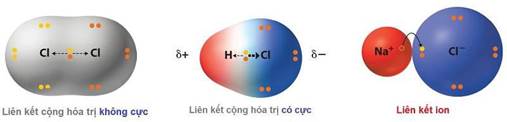
BÀI 12: LIÊN KẾT CỘNG HÓA TRỊ
I. Sự hình thành liên kết cộng hóa trị:
- Liên kết cộng hoá trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. (Liên kết cộng hoá trị được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện). + Liên kết cộng hoá trị không phân cực là liên kết cộng hoá trị trong đó cặp electron dùng chung không lệch về phía nguyên tử nào. + Liên kết cộng hoá trị phân cực là liên kết cộng hoá trị trong đó cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn. II. Liên kết cho – nhận: - Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hoá trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp. III. PHÂN BIỆT LOẠI LIÊN KẾT DỰA THEO ĐỘ ÂM ĐIỆN:
| |||||
| LIÊN KẾT HÓA HỌC |
| |||
|
| Liên kết ion | Liên kết cộng hóa trị |
| |
| Khái niệm | Lực hút tĩnh điện giữa 2 ion trái dấu. | Sự góp chung 1 hay nhiều cặp e hóa trị giữa 2 nguyên tử. |
| |
|
| Cặp electron liên kết |
|
|
|
| chuyển hẳn đến nguyên tử | Không phân cực | Phân cực | ||
Phân | nhận electron tạo thành ion | Cặp e chung ở giữa hai | Cặp e chung lệch về | ||
loại | âm và nguyên tử nhường | nguyên tử. | nguyên tử có độ âm điện | ||
| electron tạo thành ion |
| lớn hơn. | ||
| dương. |
|
| ||
|
| Nhận biết | KLđiển hình – PKđiển hình
Ví dụ: NaCl, KF,… | PK – PK (2PK giống nhau, hoặc 2 PK không khác nhau nhiều về độ âm điện) Ví dụ: H2, O2,... | PK – PK hoặc H – PK (2PK khác nhau nhiều về độ âm điện) Ví dụ: HCl, NO2,… |
| ||||||
| Hiệu đâđ | ∆χ ≥ 1,7 | 0 ≤ ∆ χ < 0,4 | 0,4 ≤ ∆ χ < 1,7 |
| ||||||
| Ví dụ | Phân tử K2O có ∆χ = 3,44 – 0,82 = 2,62 | Phân tử CH4 có ∆χ= 2,55 – 2,20 = 0,35 | Phân tử HCl có ∆χ = 3,16 – 2,20 = 0,96 |
| ||||||
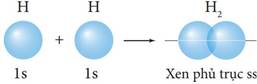
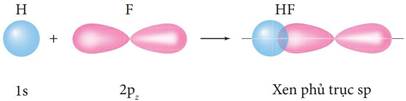
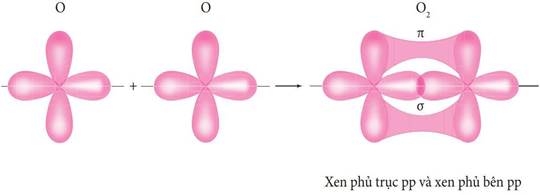
IV. SỰ HÌNH THÀNH LIÊN KẾT σ, π VÀ NĂNG LƯỢNG LIÊN KẾT:
- Năng lượng của một liên kết hoá học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí. Giá trị năng lượng của một liên kết hoá học là thước đo độ bền liên kết. | |||||||||||
 BÀI 13: LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS.
BÀI 13: LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS.
- LIÊN KẾT HYDROGEN:
 |
- Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (1000C).
- TƯƠNG TÁC VAN DER WAALS:
- Tương tác Van der waals là lực tương tác yếu giữa các phân tử hoặc nguyên tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng. (Là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử hoặc nguyên tử.)
- Tương tác Van der waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
DẠNG 1: GIẢI THÍCH QUÁ TRÌNH HÌNH THÀNH PHÂN TỬ DỰA VÀO QUY TẮC OCTET.
Câu 1: Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCl) từ nguyên tử của các nguyên tố potassium và chlorine.
Hướng dẫn giải:
 → K+ + Cl- → KCl
→ K+ + Cl- → KCl
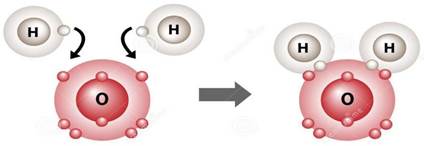
Câu 2: Giải thích sự hình thành liên kết trong phân tử H2O bằng cách áp dụng quy tắc octet.
Hướng dẫn giải:
 →
→ 
Câu 3: Vận dụng quy tắc bát tử để giải thích sự hình thành liên kết ion trong các phân tử: LiF, CaCl2.
Câu 4: Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu, có mùi tỏi, không bền, tự cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng. Phosphine sinh ra khi phân hủy xác động, thực vật và thường xuyên xuất hiện trong thời tiết mưa phùn (hiện tương “ma trơi”).
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Câu 5: Potassium iodide (KI) được sử dụng như một loại thuốc long đờm, giúp làm lỏng và phá vỡ chất nhầy trong đường thở, thường dùng cho các bệnh nhân hen suyễn, viêm phế quản mãn tính. Trong trường hợp bị nhiễm phóng xạ, KI còn giúp ngăn tuyến giáp hấp thụ iodine phóng xạ, bảo vệ và giảm nguy cơ ung thư tuyến giáp.
- Trong phân tử KI, các nguyên tử K và I đều đạt được cơ cấu bền của khí hiếm gần nhất. Đó là những khí hiếm nào?
- Vạn dụng quy tắc octet giải thích sự hình thành phân tử potassium iodide?
DẠNG 2: QUÁ TRÌNH HÌNH THÀNH CATION VÀ ANION.
Câu 6: Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống. Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
Hướng dẫn giải:
K → K+ + 1 e
1s22s22p63s23p64s1 1s22s22p63s23p6 (giống 18Ar)
potassium ion potassium hoặc cation potassium
12Mg → Mg2+ + 2e
1s22s22p63s2 1s22s22p6 (giống 10Ne)
magnesium ion magnesium hoặc cation magnesium
Câu 7: Cho các ion sau: Cl-, SO32-, NO2-, S2-, HPO42-, NH4+, Na+, O2-. Xác định ion đơn nguyên tử và ion đa nguyên tử.
Câu 8: Viết cấu hình electron của các ion: K+, Mg2+, F-, S2-. Mỗi cấu hình của ion đó giống cấu hình của nguyên tử khí hiếm nào?
Câu 9: Cho các ion sau: 20Ca2+, 13Al3+, 9F-, 16S2-, 7N3-. Viết cấu hình electron của mỗi ion. Mỗi cấu hình electron đã viết giống cấu hình electron của nguyên tử nào.
Câu 10: Cho các ion sau: K+, Be2+, Cr3+, F-, Se2-, N3-. Viết phương trình biểu diễn sự hình thành mỗi ion trên?
DẠNG 3: QUÁ TRÌNH HÌNH THÀNH LIÊN KẾT ION.
Câu 11: Trình bày sự hình thành liên kết ion trong phân tử MgO khi magnesium tác dụng với oxygen.
Hướng dẫn giải:
2Mg + O2  2MgO
2MgO
 → Mg2+ + O2- → MgO
→ Mg2+ + O2- → MgO
Câu 12: Magnesium chloride là một chất xúc tác phổ biến trong hóa học hữu cơ. Trình bày sự hình thành liên kết ion trong phân tử Magnesium chloride (MgCl2).
Câu 13: Sodium sulfide (Na2S) là một hợp chất hóa học được sử dụng trong ngành công nghiệp giấy và bột giấy, xử lí nước, công nghiệp dệt may và các quy trình sản xuất hóa chất khác như sản xuất cao su, thuốc nhuộm lưu huỳnh và thu hồi dầu… Điều thú vị là sodium sulifide đã được chứng minh là có vai trò trong bảo vệ tim mạch, chống lại chứng thiếu máu cục bộ ở tim và giúp bảo vệ phổi, chống lại tổn thương phổi do máy thở. Trình bày sự hình thành sodium sulfide khi cho sodium phản ứng với sulfur.
Câu 14: Cho các ion: Na+, Mg2+, O2-, Cl-. Những ion nào có thể kết hợp với nhau tạo thành liên kết ion?
Câu 15: Anion X- có cấu hình electron nguyên tử ở phân lớp ngoài cùng là 3p6.
- Viết cấu hình electron của nguyên tử X. Cho biết X là nguyên tố kim loại hay phi kim.
- Giải thích bản chất liên kết giữa X với barium.
Câu 16: Trong cơ thể người, nguyên tố X là thành phần cơ bản cấu tạo nên xương và răng là nguyên tố X kết hợp với phosphorus, làm cho xương và răng chắc khỏe. Nguyên tố Y chủ yếu cùng để sản xuất nhựa PVC cũng như chất dẻo hay cao su, ngoài ra nguyên tố Y còn dùng để khử trùng nước sinh hoạt. Trong hạt nhân nguyên tử X có 20 proton và nguyên tử Y có 17 electron.
- Viết cấu hình electron của nguyên tử X và Y.
- Viết công thức hợp chất hình thành giữa 2 nguyên tố X và Y. Xác định loại liên kết trong phân tử X và Y.
Câu 17: Nguyên tố X tích lũy trong các tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và chất nhạy cảm với ánh sáng. Nguyên tử X chỉ có 7 electron trên phân lớp s, còn nguyên tử Z chỉ có 17 electron trên phân lớp p. Viết công thức hóa học của hợp chất tạo bởi X và Z.
Câu 18: Cho X, Y, Z, T là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 11, 20, 17.
- Viết cấu hình electron nguyên tử các nguyên tố X, Y, Z, T.
- Viết công thức hợp chất tạo thành và xác định liên kết hóa học giữa các cặp chất X và Y, X và Z, Y vả T, Z và T.
Câu 19: Cho các chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl. Trong phân tử chất nào có liên kết ion?
Câu 20: Vì sao các hợp chất ion thường tồn tại ở thể rắn và cứng trong điều kiện thường, nhưng lại giòn và dễ vỡ?
DẠNG 4: VIẾT CÔNG THỨC ELECTRON, CÔNG THỨC CẤU TẠO, CÔNG THỨC LEWIS – HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ.
Câu 21: Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử:
Chlorine (Cl2); Bromine (Br2); Hydrogen sulfide (H2S); Ammonia (NH3).
Hướng dẫn giải:
a. Công thức electron, công thức cấu tạo và công thức Lewis của phân tử Cl2:
 |
Câu 22: Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử hợp chất hữu cơ sau:
a) Methane (CH4). b) Ethene (C2H4). c) Ethyne (C2H2).
Câu 23: Viết công thức Lewis của các phân tử Cl2, H2O và CCl4.
Câu 24: Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hoá trị trong phân tử các chất trên.
Câu 25: Trình bày sự hình thành liên kết cộng hóa trị của các phân tử carbonic acid (H2CO3), nitrous acid (HNO2)
Câu 1: Liên kết hóa học là
TRẮC NGHIỆM KHÁCH QUAN
PHẦN 1: QUY TẮC OCTET
- sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
- sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
- sự kết hợp của các phân tử hình thành các chất bền vững.
- sự kết hợp của chất tạo thành vật thể bền vững.
Câu 2: Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt cấu hình electron bền vững giống như
A. kim loại kiềm gần kề. B. kim loại kiềm thổ gần kề.
C. nguyên tử halogen gần kề. D. nguyên tử khí hiếm gần kề.
Câu 3: Vì sao nguyên tử lại liên kết với nhau thành phân tử?
- Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
- Để mỗi nguyên tử trong phân tử đều đạt được 8 electron ở lớp ngoài cùng.
- Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
- Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
 |
Câu 4: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm neon khi tham gia hình thành liên kết hoá học?
A. Sulfur. B. Oxygen. C. Hydrogen. D. Chlorine.
Câu 5: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hoá học?
A. Fluorine. B. Oxygen. C. Hydrogen. D. Chlorine.
Câu 6: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe. B. Ne. C. Ar. D. Kr.
Câu 7: Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
A. cho đi 2 e. B. nhận vào 1 e. C. cho đi 3 e. D. nhận vào 2 e.
Câu 8: Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
A. 2 electron. B. 3 electron. C. 1 electron. D. 4 electron.
Câu 9: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium. B. Neon. C. Argon. D. Krypton.
Câu 10: Nguyên tử nitrogen và nguyên tử aluminium (nhôm) có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình bền vững
A. Nhận 3 electron, nhường 3 electron. B. Nhận 3 electron, nhường 5 electron.
C. Nhận 5 electron, nhường 5 electron. D. Nhận 5 electron, nhường 3 electron.
Câu 11: Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
A. Z = 12. B. Z = 9. C. Z = 11. D. Z = 10.
Câu 12: Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride nguyên tử sodium có cấu hình bền của khí hiếm
A. helium. B. argon. C. krypton. D. neon.
Câu 13: Khi tham gia hình thành liên kết hóa học, các nguyên tử lithium và chlorine có khuynh
hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
A. Helium và argon. B. Helium và neon. C. Argon và helium. D. Neon và argon.
Câu 14: Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
A. Helium và xenon. B. Helium và radon. C. Helium và krypton. D. Neon và argon.
Câu 15: Cho các ion: Ca2+, F– , Al3+ và N3–. Số ion có cấu hình electron của khí hiếm neon là
A. 4 B. 2 C. 1 D. 3
Câu 16: Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình bền của khí hiếm neon?
A. 3. B. 2. C. 5. D. 4.
Câu 17: Nguyên tử nào sau đây là trường hợp ngoại lệ với quy tắc octet?
A. H 2O. B. NH 3. C. HCl. D. BF 3.
Câu 18: Phân tử nào sau đây có nguyên tử đều đạt cấu hình electron bão hòa theo quy tắc octet?
A. BeH 2. B. AlCl 3. C. PCl 5. D. SiF 4.
Câu 19: Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
A. H 2O. B. NO 2. C. CO 2. D. Cl 2.
Câu 20: Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia
liên kết là
A. 2. B. 3. C. 4. D. 5.
PHẦN 2: LIÊN KẾT ION – LIÊN KẾT CỘNG HÓA TRỊ - LIÊN KẾT HYDROGEN.
Câu 21: Liên kết ion được tạo thành giữa hai nguyên tử bằng
- một hay nhiều cặp electron dùng chung.
- một hay nhiều cặp eletron dùng chung chỉ do một nguyên tử đóng góp.
- lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- một hay nhiều cặp electron dùng chung và các cặp electron này lệch về nguyên tử có độ
âm điện lớn hơn.
Câu 22: Liên kết cộng hóa trị là liên kết
- giữa các phi kim với nhau.
- trong đó cặp electron chung bị lệch về một nguyên tử.
- được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
- được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Câu 23: Phát biểu nào sau đây là đúng?
- Trong liên kết cộng hóa trị, cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
- Liên kết cộng hóa trị có cực được tạo thành giữa hai nguyên tử có hiệu độ âm điện từ 0,4
đến nhỏ hơn 1,7.
- Liên kết cộng hóa trị không cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
- Hiệu độ âm điện giữa hai nguyên tử lớn thì phân tử phân cực yếu.
Câu 24: Phát biểu nào sau đây là đúng?
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa nguyên tử kim loại với phi kim.
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một cặp e chung.
- Liên kết cộng hóa trị không cực là liên kết giữa 2 nguyên tử của các nguyên tố phi kim.
- Liên kết cộng hóa trị phân cực trong đó cặp e chung bị lệch về phía 1 nguyên tử.
Câu 25: (CĐ-2013) Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. cộng hoá trị không cực. B. hydrogen.
C. cộng hoá trị có cực. D. ion
Câu 26: (CĐ-2010)Liên kết hoá học giữa các nguyên tử trong phân tử H 2O là liên kết
A. cộng hoá trị không phân cực. B. hydrogen.
C. cộng hoá trị phân cực. D. ion
Câu 27: (A-2013) Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
A. cộng hoá trị không cực. B. hydrogen.
C. cộng hoá trị có cực. D. ion
Câu 28: (A-2014) Liên kết hóa học giữa các nguyên tử trong phân tử NH3 thuộc loại liên kết
A. cộng hoá trị không cực. B. hydrogen.
C. cộng hoá trị có cực. D. ion
Câu 29: (A-2008) Hợp chất trong phân tử có liên kết ion là
A. HCl. B. NH3. C. H 2O. D. NaCl.
Câu 30: Điều nào sau đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
- Trong phân tử Na2O, các ion sodium Na+ và ion oxide O2- đều đạt cấu hình electron bền vững của khí hiếm neon.
- Phân tử Na2O tạo bỡi lực hút tĩnh điện giữa hai ion Na+ và một ion O2-..
- Là chất rắn trong điều kiện thường.
- Không tan trong nước chỉ tan trong dung môi không phân cực như benzene, cacbon
tetrachloride.
Câu 31: Tính chất nào sau đây không phải của magnesium oxide (MgO)?
- Có nhiệt độ nóng chảy cao hơn NaCl.
- Chất khí ở điều kiện thường.
- Có cấu trúc tinh thể.
- Phân tử tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2-.
Câu 32: Tính chất nào dưới đây đúng khi nói về hợp chất ion?
- Hợp chất ion có nhiệt độ nóng chảy thấp.
- Hợp chất ion tan tốt trong dung môi không phân cực..
- Hợp chất ion có cấu trúc tinh thể.
- Hợp chất ion dẫn điện ở trạng thái rắn.
Câu 33: Tính chất nào dưới đây là tính chất của hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp. B. Hợp chất ion có nhiệt độ nóng chảy cao.
C. Hợp chất ion có nhiệt độ sôi không xác định. D. Hợp chất ion dễ hóa lỏng.
Câu 34: Hợp chất A có tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là
A. sodium chloride. B. glucose. C. sucrose. D. fructose.
Câu 35: Trong phân tử ammonia (NH3), số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là
A. 3. B. 2. C. 1. D. 4.
Câu 36: Phát biểu nào sau đây không đúng về liên kết có trong phân tử HCl?
- Giữa nguyên tử H và Cl có một liên kết đơn.
- Các electron tham gia liên kết đồng thời bị hút về phía hạt nhân.
- Phân tử có momen lưỡng cực.
- Một electron của nguyên tử hydrogen và một electron của nguyên tử chlorine được góp chung và cách đều hai nguyên tử.
Câu 37: Liên kết ion khác với liên kết cộng hóa trị ở điểm nào sau đây?
A. Tính bão hòa lớp electron ở vỏ nguyên tử. B. Tuân theo quy tắc octet.
C. Tạo ra hợp chất bền vững hơn. D. Tính không định hướng.
Câu 38: Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hóa trị?
- Các hợp chất cộng hóa trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất
ion.
- Các hợp chất cộng hóa trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
- Các hợp chất cộng hóa trị đều dẫn điện tốt.
- Các hợp chất cộng hóa trị không phân cực tan được trong dung môi không phân cực.
Câu 39: Có bao nhiêu phân tử trong số các phân tử sau có liên kết ion: BaCl2, CS2, Na2O và HI.
A. 1. B. 3. C. 2. D. 4.
Câu 40: Cho các chất sau: N2, H2, NH3, NaCl, HCl, H2O. Số chất mà phân tử chỉ có liên kết cộng hóa trị không phân cực là
A. 2. B. 3. C. 4. D. 5.
Câu 41: (CĐ-2009) Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
A. O2, H2O, NH3 B. H 2O, HF, H2S C. HCl, O 3, H2S D. HF, Cl 2, H2O
Câu 42: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
A. Cl2, Br2, I2, HCl. B. Na2O, KCl, BaCl2, Al2O3.
C. HCl, H2O, NaCl, N2O D. MgO, H2SO4, H3PO4, HCl.
Câu 43: Dãy các chất mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực là
A. N 2, CO2, Cl2, H2. B. N2, Cl2, H2, HCl.
C. N 2, HI, Cl2, CH4. D. Cl2, O2, N2, F2.
Câu 44: (B-2013) Cho giá trị độ âm điện của các nguyên tố: F (3,98), O (3,44), C (2,55), H (2,20), Na (0,93), Hợp chất nào sau đây là hợp chất ion
A. NaF B. CH 4 C. H 2O D. CO 2
Câu 45: Phân tử nào sau đây có liên kết cộng hóa trị phân cực mạnh? (Biết độ âm điện của Cl=3,16; N=3,04; C=2,55; H=2,2)
A. H 2 B. CH 4 C. N 2 D. HCl.
Câu 46: (CĐ-2011) Mức độ phân cực của liên kết hoá học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là (Biết độ âm điện của các nguyên tố như sau: H (2,2); Cl 3(,16); Br (2,96) và I (2,66).
A. HBr, HI, HCl B. HI, HBr, HCl C. HCl , HBr, HI D. HI, HCl , HBr
Câu 47: Cho độ âm điện của H = 2,2, Na = 0,93, C = 2,55 và O = 3,44. Liên kết nào dưới đây là liên kết cộng hóa trị không phân cực?
A. Na-O. B. O-H. C. Na-C. D. C-H.
Câu 48: Cho giá trị độ âm điện của một số nguyên tố sau: Na (0,93), Li (0,98), Mg (1,31), Al (1,61), P (2,19), S (2,58), Br (2,96) và Cl (3,16). Phân tử nào trong số các phân tử dưới đây có chứa liên kết ion?
A. Na3P. B. MgS. C. AlCl 3. D. LiBr.
Câu 49: Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử
A. HCl, Cl2, NaCl B. NaCl, Cl 2, HCl C. Cl 2, HCl, NaCl D. Cl 2, NaCl, HCl
Câu 50: Phân tử chất nào sau đây ít phân cực nhất?
A. HCl B. HF C. HI D. HBr
Câu 51: Độ âm điện của các phi kim giảm dần theo thứ tự F, Cl, Br, H. Lực kéo electron về phía nguyên tử nitrogen mạnh nhất ở liên kết nào dưới đây?
A. N-H. B. N-F. C. N-Cl. D. N-Br
Câu 52: Liên kết nào sau đây phân cực nhất?
A. C-H. B. C-F. C. C-Cl. D. C-Br
Câu 53: Khả năng hoạt động của các phi kim giảm dần theo thứ tự sau: F, O, Cl. Liên kết trong phân tử nào sau đây có độ âm phân cực lớn nhất?
A. FCl B. F 2O C. Cl 2O D. Cl 2
Câu 54: (ĐHB10) Các chất mà phân tử không phân cực là
A. HBr, CO2, CH4 B. Cl 2, CO2, C2H2 C. HCl, C 2H2, Br2 D. NH 3, Br2, C2H4 Câu 55: Tổng số các phân tử có cực trong số các phân tử Cl2, O2, CCl4, CO2 và SO2 là bao nhiêu phân tử?
A. 1. B. 3. C. 2. D. 4.
Câu 56: Số hiệu nguyên tử của X, Y lần lượt là 11 và 9 . Liên kết giữa hai nguyên tử X và Y thuộc loại liên kết nào sau đây?
A. Liên kết ion. B. Liên kết cộng hoá trị phân cực.
C. Liên kết cộng hoá trị không phân cực. D. Liên kết cho – nhận.
Câu 57: Cho 2 nguyên tố X và Y là nguyên tố nhóm A. X thuộc nhóm IIA và Y thuộc nhóm VA. Hợp chất tạo bởi X và Y có công thức đơn giản nhất là
A. X2Y3 B. X2Y5 C. X 5Y2 D. X 3Y2.
Câu 58: Nguyên tử nguyên tố X có cấu hình electron lớp ngoài cùng là 3s23p1, nguyên tử nguyên tố Y có cấu hình electron lớp ngoài cùng là 2s22p4. Hợp chất tạo bởi X và Y có công thức
A. X2Y3. B. X 3Y2. C. X 2Y. D. XY 3.
Câu 59: Nguyên tố X có 19 proton còn Y có 8 proton. Công thức của hợp chất hình thành bởi X và Y và loại liên kết hóa học giữa chúng lần lượt là
A. XY | 2 với liên kết cộng hóa trị | B. X | 2Y với liên kết cộng hóa trị |
C. XY | 2 với liên kết ion | D. X | 2Y với liên kết ion |
Câu 60: Nguyên tố X ở nhóm VIA và nguyên tố Y ở nhóm VIIA của bảng tuần hoàn. X và Y có thể tạo thành hợp chất R. Liên kết giữa các nguyên tử R thuộc loại liên kết nào sau đây?
A. Ion. B. Cộng hóa trị phân cực.
C. Cộng hóa trị không phân cực. D. Hydrogen.
Câu 61: X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Các cặp nguyên tố có thể tạo thành liên kết ion và cộng hóa trị phân cực lần lượt là
A. (X, Y); (X, Z) và (Y, Z). B. (X, Z); (Y, Z) và (X, Y).
C. (X, Y); (Y, Z) và (X, Z). D. (X, Y), (Y, X) và (X, Z).
Câu 62: Trong phân tử nào chỉ tồn tại liên kết đơn?
A. N2 B. O 2 C. F 2 D. CO 2.
Câu 63: Cho các phân tử: H2, CO2, Cl2, N2, I2, C2H4, C2H2. Có bao nhiêu phân tử có liên kết ba trong phân tử?
A. 1. B. 2 C. 3. D. 4.
Việt Yên, ngày 24 tháng 11 năm 2022
Giáo viên báo cáo
Nguyễn Hữu Mạnh



.jpg)